杨森药业委托专业研究所对车间多项检测
发布时间:2021-07-13
今日杨森药业委托广州微生物研究所对车间多项检测:
浮游菌
沉降菌
悬浮粒子
混合照度
温度、湿度、压差
空气中细菌菌落总数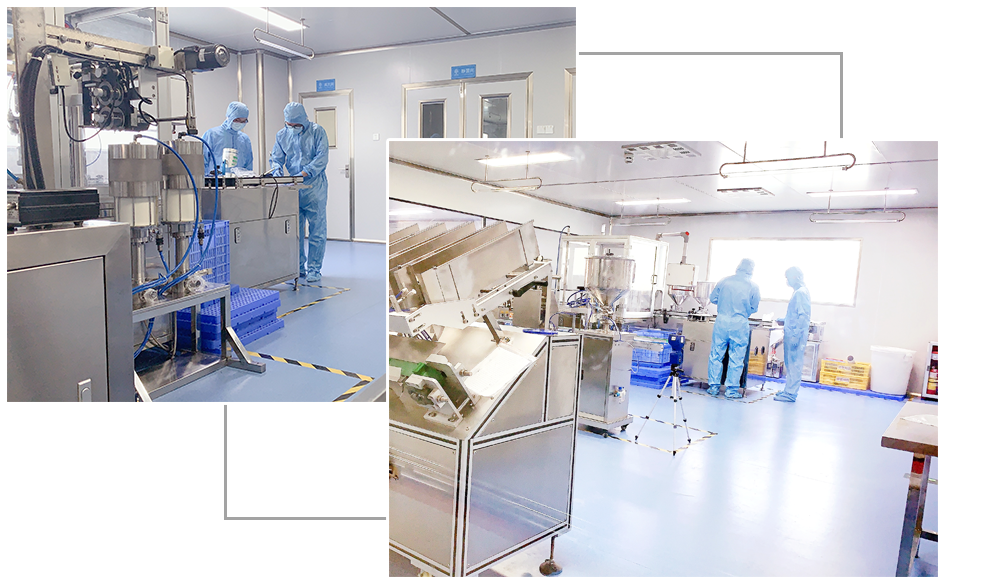
附:39条、生产车间应按产品工艺环境控制需求分为清洁区、准清洁区和一般区。制定车间环境监控计划,定期监控。
(1)检查是否按产品工艺合理划分清洁区、准清洁区和一般区;
(2)检查环境监控计划,是否按计划实施;
(3)检查是否有有效的检测报告。 1.车间区域划分的平面布局图(三区划分),平面布局图应能够识别相应的区域(可与第36项的“生产车间平面图”整合。2.车间环境监控制度及相应的环境监控计划、监控记录,并有相应的分析,针对不合格情况的改进措施报告或记录。3.一年内车间细菌总数检测报告:该报告需经过国家相关部门任何的检测机构出具或企业具备自检能力且通过CNAS认可的自检报告或企业使用检测仪器设备经过法定计量检定且用法定标准出具的自检报告。
附:40条、生产眼部用护肤类、婴儿和儿童用护肤类化妆品的灌装间、清洁容器存储间应达到30万级洁净要求。生产区之间应根据工艺质量保证要求保持相应的压差,清洁区与其他生产区保持一定的正压差。生产车间温度、相对湿度控制应满足产品工艺要求。
(1)查看生产车间空气检测报告,参考《GB 50457-2008 医药工业洁净厂房设计规范》30万级标准;检查生产区内是否设置指示压差的装置;
(2)清洁区与其他生产区保持一定的正压差;
(3)易产生粉尘的功能间与其他功能间保持一定的负压差。
(4)检查温度和湿度的控制要求、监控制度;
(5)检查监控制度的执行情况。 1.空气净化系统竣工验收文件。2.一年内的30万级空气洁净度检测报告(检测项目至少应包括悬浮粒子、浮游菌/沉降菌、温度、湿度、压差等),该报告需经过国家相关部门任何的检测机构出具或企业具备自检能力且通过CNAS认可的自检报告或企业使用检测仪器设备经过法定计量检定且用法定标准出具的自检报告。3.压差、温度和相对湿度监控的文件或相关证明资料。4.压差、温度、相对湿度监控记录。
下一个
下一个
相关新闻
广东省药品监督管理局关于化妆品抽样检验信息的通告(2021年第3期)
根据我省2020年化妆品监督抽检工作安排,本期涉及全省633批次化妆品的抽样检验信息,经检验合格样品607批次,不合格样品26批次,现予通告。
2021-04-19
依据《化妆品监督管理条例》(以下称《条例》),《化妆品注册备案管理办法》(以下称《办法》)《化妆品注册备案资料管理规定》(以下称《规定》),国家药监局化妆品监管司整理了化妆品业界就化妆品注册备案相关规定反映的问题,逐一进行了解答。
2021-04-19